天然产物因其结构多样性和显著生物活性,一直是抗肿瘤药物研发的重要来源。其中,萘嵌苯酮类化合物因兼具抗菌、抗炎和抗肿瘤等多重活性,被视为极具潜力的药物先导分子。然而,长期以来,其“还原型萘嵌苯酮骨架”的生物合成机制始终未被阐明,成为制约相关活性分子开发的重要科学难题。
近日,我院李力教授团队在该领域取得突破性进展。相关研究成果以《Discovery and Biosynthesis of Cytotoxic Myroverols: A Phenalenone Scaffold Constructed by a Fungal Highly Reducing Polyketide Synthase and a Cytochrome P450》为题,发表于国际知名期刊《Organic Letters》(中科院一区TOP,DOI:10.1021/acs.orglett.5c04685)。
该研究首次揭示了还原型萘嵌苯酮骨架的生物合成新机制,并发现多种具有显著抗肿瘤活性的全新天然产物。研究团队从植物病原真菌疣孢漆斑菌中挖掘并解析了一个具有独特功能的myr 基因簇,通过异源表达与结构鉴定,成功获得并命名了3 种全新化合物 Myroverol A–C。研究表明,该类化合物由一种高度还原型多聚酮合酶与细胞色素P450协同催化生成,构建出此前未知的还原型萘嵌苯酮骨架,填补了该领域的研究空白。
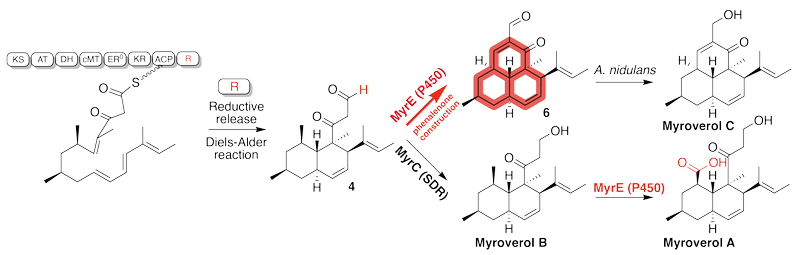
体外活性评价显示,Myroverol A–C对肺癌、胰腺癌、宫颈癌及胃癌等多种肿瘤细胞具有显著抑制作用,活性水平可与临床常用化疗药物顺铂相当,其中Myroverol B表现出尤为突出的抗肿瘤潜力。此外,研究还揭示了该基因簇通过“分支调控”机制产生不同骨架天然产物的新模式,为合成生物学定向构建复杂活性分子提供了新思路。
本研究以星空下载游戏推荐安卓为第一完成单位,2022级博士研究生林威为第一作者,李力教授、张明亮老师与上海交通大学唐满成副教授为共同通讯作者。研究工作得到国家重点研发计划和国家自然科学基金等项目资助。
全文链接:https://pubs.acs.org/doi/pdf/10.1021/acs.orglett.5c04685?ref=article_openPDF
